De la molécule au médicament

Comment un nouveau médicament est-il développé ?
Le développement d'un nouveau médicament nécessite de la haute technologie, du savoir-faire, un grand engagement — et de la persévérance : la durée moyenne d'un développement est de plus de dix ans et coûte environ 1 à 2 milliards de dollars. Une fois que le besoin d'un nouveau médicament pour une maladie donnée a été identifié, la première étape consiste à découvrir une substance qui pourrait être utilisée pour guérir ou atténuer cette maladie. Ces substances peuvent être de petites molécules, c'est-à-dire des composés ou des extraits chimiquement purs d'origine végétale ou animale, ou des produits biologiques fabriqués par des moyens issus de la biotechnologie et des organismes génétiquement modifiés. Toutefois, cela nécessite un long chemin de tests et de développement avant qu'une substance qui entre en ligne de compte comme principe actif ne devienne un médicament sûr et efficace chez l'homme. De nombreuses substances actives échouent : sur plusieurs milliers de substances envisagées au départ par les scientifiques, seule une substance active est finalement mise sur le marché en tant que médicament.
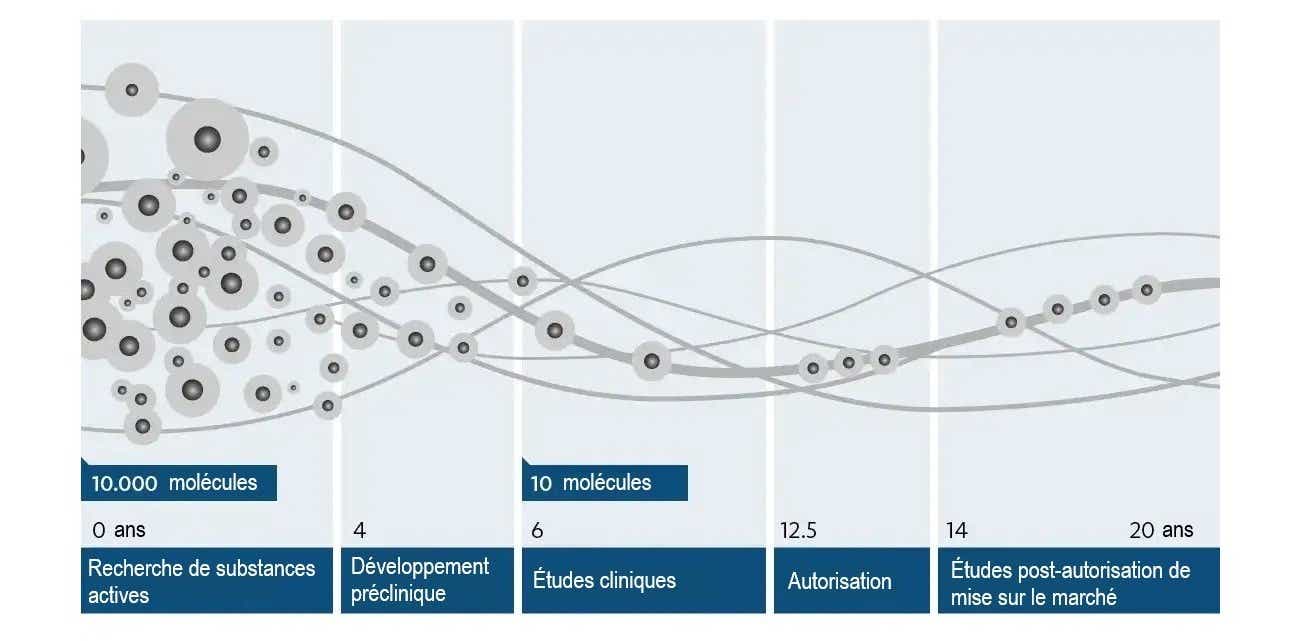
1) La recherche d'un nouveau principe actif
Les connaissances scientifiques sur la cause d’une maladie fournissent souvent une base pour la recherche de nouveaux principes actifs. Une plus grande importance est accordée aux connaissances issues de la recherche fondamentale sur la fonction des protéines humaines, les plus petits éléments biologiques du corps humain. En effet, les protéines qui jouent un rôle dans les processus pathologiques présentent des cibles potentielles en tant que points de départ pour le traitement d'une maladie. En collaboration avec les départements de médecine, de chimie, de biologie et de technologie de l'information, de nouvelles substances qui se lient à ces protéines cibles et influencent leur fonction sont recherchées et formées au cours de cycles de tests complexes sur des cultures cellulaires en laboratoire et simulées sur ordinateur.
2) Développement préclinique
Un candidat-médicament prometteur fait l'objet d'un programme de recherche complet. Les premiers tests sont effectués dans des éprouvettes et des cultures cellulaires (in vitro). Dans la mesure du possible, Janssen renonce à l’expérimentation animale et travaille de plus en plus avec des cultures cellulaires ou des unités encore plus petites, appelées structures subcellulaires. Toutefois, certaines propriétés ne peuvent être vérifiées que dans l'organisme entier (in vivo). Pour cette raison, les candidats-médicaments ayant réussi les tests in vitro sont également testés sur modèles animaux.
Les experts en pharmacocinétique et en pharmacodynamie examinent les effets sur l'organisme et le comportement du corps face à la substance active. Outre l’efficacité, l’absorption, la distribution et l’excrétion/la dégradation de la substance dans l'organisme animal sont également étudiées. Des dispositifs expérimentaux et des méthodes d'analyse sophistiqués sont utilisés pour évaluer comment les résultats des tests sur l'animal peuvent être transférés ultérieurement à l'homme (Recherche translationnelle).
Les études toxicologiques se concentrent principalement sur l’innocuité de la substance active pour l’Homme. Les substances sont mises à l’épreuve — après tout, de nouvelles substances pourraient avoir des effets toxiques sur le corps, influencer la capacité de reproduction et le développement des embryons, provoquer un cancer ou provoquer des mutations génétiques.
Ce n'est que lorsqu'une substance a passé tous les tests précliniques et a été classée comme inoffensive qu'elle peut être testée sur l'Homme. En outre, le mode d’administration doit être déterminé : Le médicament doit-il être administré par voie orale ou par injection ? On doit également examiner la possibilité de produire le médicament potentiel à l'échelle industrielle. Ce n'est qu'ensuite que le médicament passe à la recherche clinique.
3) Études cliniques
Les substances doivent confirmer leur efficacité et leur tolérance chez l'Homme dans le cadre d'études cliniques avant de pouvoir obtenir une autorisation de mise sur le marché en tant que médicament. On distingue les études des phases I à IV, qui doivent généralement être suivies dans l'ordre. Pour qu'un principe actif puisse être mis à la disposition de l'Homme dans la bonne composition et à la bonne dose, la forme d'administration (p. ex. comprimés, capsules, solutions injectables, etc.) est également développée dans ce contexte (pharmacie galénique).
D’autres essais cliniques peuvent également être utiles après l’autorisation, par exemple si le fabricant souhaite obtenir une autorisation pour d'autres indications thérapeutiques, formes galéniques ou dosages.
4) Autorisation
Dans le cadre de la procédure d'autorisation de mise sur le marché, les documents soumis par le fabricant du médicament concernant la qualité pharmaceutique, l'effet thérapeutique et l'innocuité sont examinés par les autorités compétentes.
L'autorisation pour la Suisse est délivrée par Swissmedic.5) Études post-autorisation de mise sur le marché
Après l'autorisation de mise sur le marché, il est souvent nécessaire de répondre à d'autres questions sur l'utilisation d'un médicament dans des conditions quotidiennes. Cela peut être fait dans le cadre d’essais cliniques interventionnels de phase IV ou par des études non interventionnelles dans lesquelles le médicament est utilisé conformément à la routine habituelle sans que des examens spécifiques à l'étude soient prescrits.
Vous trouverez de plus amples informations sur les médicaments sur le site Web d'Interpharma.