Recherche et essais cliniques
Recherche et études cliniques avant l'autorisation de mise sur le marché
Qu'est-ce qu'un essai clinique ?
Phases des essais cliniques
On distingue quatre phases dans les essais cliniques :
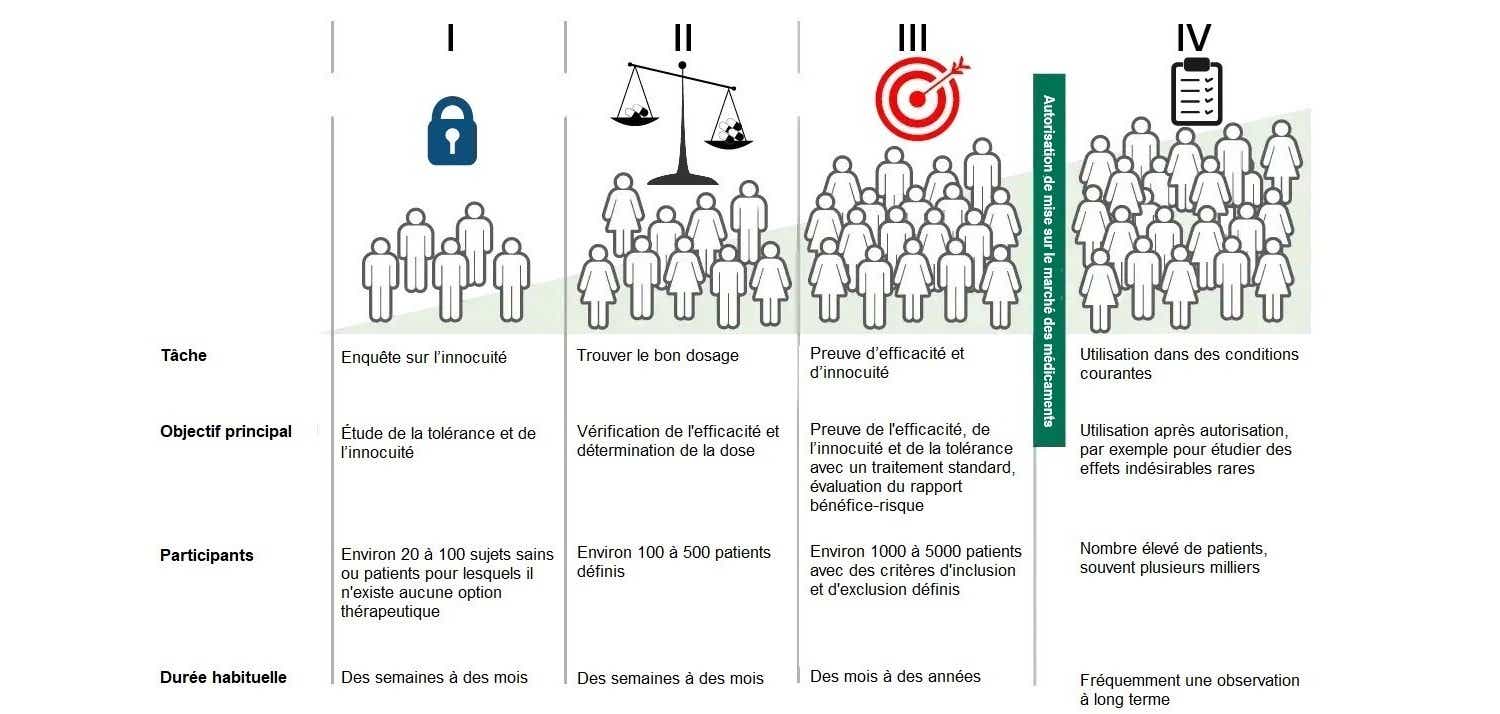
Pourquoi faire des essais cliniques ?
Avant qu'un médicament ne soit mis sur le marché ou autorisé pour le traitement d'une autre/nouvelle maladie, son efficacité et sa sécurité doivent être démontrées dans des études, également appelées études cliniques ou essais cliniques.
Après l'autorisation de mise sur le marché (c'est-à-dire l'autorisation de vendre le médicament), d'autres études peuvent être nécessaires afin d'acquérir des connaissances supplémentaires sur un médicament.
En tant qu'entreprise de recherche clinique, Janssen s'engage à respecter des normes élevées en matière de recherche et de développement. Nos essais cliniques répondent à des exigences scientifiques, juridiques et éthiques strictes. La sécurité et la protection des personnes qui y participent sont notre priorité absolue.
Phases des études cliniques préalables à l'autorisation d'un médicament (phases I à III)
Phase I
Lors de la phase clinique I, un médicament est utilisé pour la première fois chez l'Homme afin d'étudier la tolérance, la sécurité et la pharmacocinétique, c'est-à-dire le comportement de la substance active dans l'organisme. Les participants à l'étude sont généralement un petit nombre de volontaires en bonne santé.
Les premières données sur la sécurité et la dose maximale tolérée sont collectées. Habituellement, on étudie également les propriétés pharmacocinétiques de la substance - c'est-à-dire sa distribution et son élimination dans l'organisme -, ainsi que l'influence des repas et les interactions avec d'autres substances actives. Une fois l'évaluation des bénéfices et des risques réussie, la molécule candidate peut passer à la phase II de l'essai clinique.
Phase II
Pour la première fois, l'utilisation chez des patients souffrant d'une maladie spécifique est étudiée : il s'agit de vérifier auprès d'un groupe de patient(e)s strictement défini si la préparation est efficace pour le traitement de la maladie et à quelle dose.
Phase III
Si le médicament a passé avec succès la phase II, des études de phase III examinent l'efficacité et la tolérance de la substance testée et poursuivent l'évaluation des bénéfices et des risques. Un groupe plus large de participants, souvent plus de 1000 patients, permet de mieux évaluer les effets indésirables, même rares.
Les essais cliniques visant à obtenir l’autorisation de mise sur le marché du médicament sont réalisés sous la forme d’essais randomisés contrôlés, dans lesquels les patients sont répartis en deux groupes de traitement. Dans l'un des groupes de traitement, on choisit la forme d'administration et la dose de la substance d'essai qui seront valables pour l'utilisation sur le marché. Les comparaisons sont généralement faites avec un groupe de traitement de contrôle dans lequel les patients reçoivent le traitement standard habituel pour la maladie. L’attribution des patients à l’un des groupes de traitement se fait de manière aléatoire (randomisation).
Que se passe-t-il après l'autorisation de mise sur le marché d'un médicament ?
Les études cliniques menées après l'autorisation de mise sur le marché d'un médicament sont également appelées études de phase IV. Les études sur le médicament autorisé servent à obtenir des données supplémentaires sur de grands groupes de patients. Les études de la phase IV sont donc menées dans l'indication, la posologie et la forme galénique autorisées. Souvent, l’un des objectifs est d’enregistrer les effets indésirables ou les interactions avec d’autres médicaments rares. Selon la question posée, des groupes de patients spécifiques sont considérés, par exemple les enfants, les personnes âgées ou les personnes concernées par une maladie ou une exposition particulière.
Plus d'informations sur :
Que signifie la participation à un essai clinique pour le patient ?
À QUOI DOIS-JE M'ATTENDRE SI JE PARTICIPE À UN ESSAI CLINIQUE ?
Si vous souhaitez participer à un essai clinique, votre médecin doit consulter un document très détaillé sur l’essai clinique, conformément aux dispositions légales. Ce document s’intitule « Feuille d'information et déclaration de consentement ». Le présent document vise à garantir que :
vous comprenez parfaitement l'étude clinique, y compris toutes les procédures, les effets indésirables possibles et les autres risques qui peuvent être liés à la participation à l'étude ou à son déroulement.
vous êtes conscient de votre responsabilité en tant que participant à l’essai clinique
vous avez reçu la réponse à toutes vos questions relatives à l’essai clinique
vous savez que vous pouvez quitter l'essai clinique à tout moment sans donner de raison.
Vous recevrez également des informations sur de nombreux autres points, tels que la couverture d'assurance et la protection des données. Toutes les questions que vous aurez après avoir lu l’information du patient pourront être discutées en détails avec votre médecin. Après l'entretien, vous aurez le temps de réfléchir à une participation à l'étude. Si vous choisissez de participer, vous devez signer la déclaration écrite de consentement.
QUE SE PASSE-T-IL SI JE CHANGE D'AVIS ?
Même si vous avez accepté de participer à l'essai clinique, vous pouvez changer d'avis et mettre fin à votre participation à l'essai clinique à tout moment. Vous n'avez pas à motiver votre décision.
LA PARTICIPATION ENTRAÎNERA-T-ELLE DES FRAIS POUR MOI ?
Non. Si vous êtes éligible pour participer à l'étude clinique, vous recevrez gratuitement le médicament expérimental ainsi que la totalité de la prise en charge liée à l'étude.
Quels sont les points que je devrais aborder avec mon médecin ?
Liste de contrôle :
- Quel est l'objectif concret de l'étude clinique ?
- Comment le déroulement de l'étude est-il prévu ?
- Qui finance l'étude ?
- La participation à l'étude entraîne-t-elle des coûts pour vous ?
- Y a-t-il une indemnisation pour les frais ?
- Une assurance de participation a-t-elle été souscrite ?
- Quel est le temps nécessaire pour participer ?
- Quelles sont les obligations associées à la participation à l’étude ?
- Un suivi plus long est-il nécessaire après la fin de l'étude ?
- Quels sont les avantages et les risques de la participation à une étude par rapport aux méthodes thérapeutiques existantes ?
- Quelles sont les expériences déjà disponibles en ce qui concerne le nouveau traitement ?
- Quels sont les effets indésirables à prévoir ?
- Qui est responsable du suivi de l'étude ?
- Qui peut être contacté en cas d’urgence ou en cas de questions ?
- Quelles données sont collectées, traitées et stockées ?
- À quelles restrictions faut-il s’attendre au début ou pendant l’essai clinique (par exemple, pas de grossesse, pas d’alcool) ?
- Que se passe-t-il si l'étude est interrompue prématurément ?
- Le cas échéant, comment le traitement peut-il être poursuivi après la fin de l’étude ?
Vous trouverez de plus amples informations sur les études cliniques sur le site Web d'Interpharma.